时间:2023-07-08 08:07:00 点击次数:18
先上个思维导图来给大家「开开胃」:
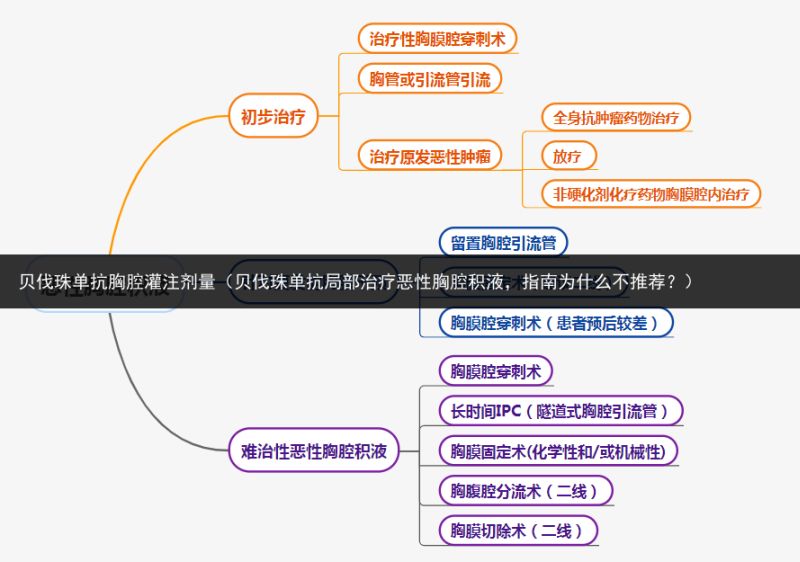 打开凤凰新闻,查看更多高清图片
打开凤凰新闻,查看更多高清图片图:恶性胸腔积液的处理;图源:笔者
那么说到恶性胸腔积液的治疗,先回顾一下背景知识,温故而知新:
恶性胸腔积液(malignant pleural effusion, MPE)是非小细胞肺癌常见并发症。恶性胸腔积液可导致呼吸困难、咳嗽和胸痛,最终可能损害心脏的正常功能,从而威胁患者的生存。
MPE 发病率高、预后差,其预后仅有 3 个月的生存,因此对于胸腔积液积极管理能提高患者的生存时间和生存质量。
目前 MPE 患者的治疗方式主要依赖于局部治疗,如引流管、胸膜固定术及胸腔内化疗灌注,常用化疗药物有多柔比星、顺铂、阿糖胞苷、卡铂、依托泊苷、丝裂霉素和氟尿嘧啶。
但今天要聊的「主角」并不是化疗药,咱主要说说抗血管生成药:
近几年抗血管生成药物全身及局部治疗肺癌引起的恶性胸腔积液的疗效得到大家的充分认可,但其局部治疗方式尚未得到药品说明书、恶性胸腔积液的指南及共识的推荐。
对此笔者总结了抗血管生成药物治疗恶性胸腔积液的一些循证医学证据及专家共识,整体评价一下其治疗恶性胸腔积液的效果。
话不多说,言归正传。
贝伐珠单抗与恶性胸腔积液
贝伐珠单抗的作用机制:
贝伐珠单抗是一种重组人源化 IgG1 单克隆抗体,包括人类抗体框架区以及可结合血管内皮生长因子(VEGF)的人源化鼠抗体的抗原结合区。
它可以选择性地与 VEGF 结合并阻断其生物活性,可以抑制 VEGF 与其位于内皮细胞上的受体 VEGFR-1 和 VEGFR-2 结合,从而使 VEGF 失去生物活性而减少肿瘤的血管生成,因此抑制了肿瘤的生长。
贝伐珠单抗用于恶性胸腔积液的方案:
贝伐珠单抗治疗恶性胸腔积液的方案包括全身应用和局部应用。
全身应用方面:
伴有恶性胸腔积液肺癌的患者绝大多数为晚期肿瘤患者,这部分患者使用化疗联合贝伐珠单抗治疗方案符合药品说明书和诊疗指南的推荐,因而贝伐珠单抗全身给药方式是没有争议的。
局部应用方面:
另一种方式是贝伐珠单抗胸腔灌注这种局部给药方式,这种治疗方式相比全身静脉给药方式的优点是局部用药浓度高、疗效好,且全身不良反应更低。
缺点是该用药方式尚未获得指南和说明书推荐,也不符合医保报销条件,属于超指南 / 说明书 / 医保给药,因而这会导致患者负担重且医师需走超说明书用药告知备案、自费用药告知备案等流程。
贝伐珠单抗局部应用疗效:
至于贝伐珠单抗局部治疗疗效,我们首先看一项来自国内解放军总医院的临床研究。
研究1
该研究纳入 72 例伴发恶性胸腔积液的晚期转移性非鳞 NSCLC 患者,分析局部胸腔灌注贝伐珠单抗联合顺铂的治疗效果。受试者胸膜内给予 30 mg 顺铂加 300 mg 贝伐珠单抗或 30 mg 顺铂单药治疗,每两周 1 次,进行 3 周期的治疗。
结果显示,联合治疗组患者的胸腔积液控制率显著高于顺铂单药治疗组(88.33% vs. 50.00%,P < 0.05);联合治疗组的 PFS 有显著延长获益,mPFS 5.3 vs. 4.5 个月, p < 0.05;胸水中的 VEGF 水平在联合治疗后也显著降低,且两组之间 VEGF 水平的降低幅度具有统计学意义(P < 0.01);此外,在 VEGF 高表达患者中,贝伐珠单抗联合化疗局部灌注治疗的治疗有效率更高(P < 0.001)。治疗过程中患者的耐受性良好。
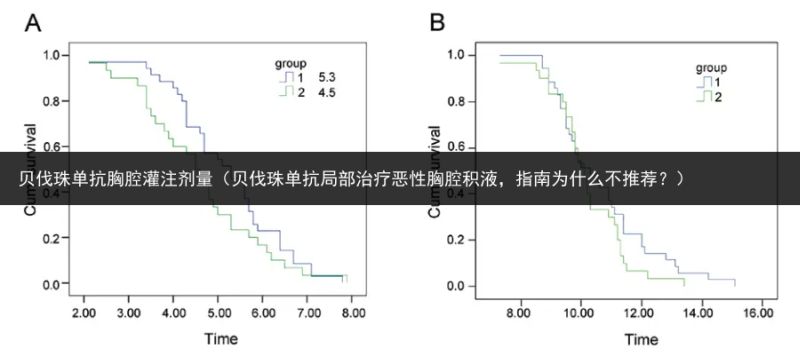
图:左图 A 为两组 PFS 结果,mPFS 5.3 VS. 4.5 个月, p < 0.05;右图为两组 OS 结果,mOS 10.3 VS. 10.1 个月, p > 0.05,参考文献 1
再来看看一项来自山东省肿瘤医院的临床研究。
研究2
山东省肿瘤医院的一项单中心回顾性临床研究共纳入 996 名恶性浆液性腔积液患者,其中恶性胸腔积液患者(MPE)有 574 名,治疗方案分为四组:胸腔注射贝伐珠单抗、胸腔内注射化疗药物、胸腔内注射免疫调节剂和单纯胸腔穿刺术。
结果显示,四组患者胸腔积液的控制率分别为 90.00%、82.40%、67.59% 和 46.55%。胸腔内注射贝伐珠单抗治疗 MPE 的控制率明显高于其他三种治疗方法,p < 0.05。
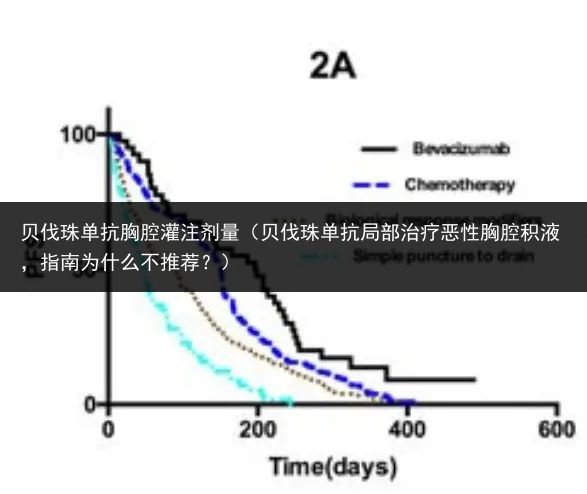
图:574 名 MPE 患者四种治疗方式的回顾性分析 PFS 结果,贝伐珠单抗治疗组明显优于其他 3 种治疗模式(胸腔内注射化疗药物、胸腔内注射免疫调节剂、单纯胸腔穿刺术),p < 0.05,参考文献 2
还有另外一项 Meta 分析。
研究3
这项 Meta 分析汇总了 769 例伴有 MPE 的 NSCLC 患者,胸腔内注射贝伐珠单抗联合铂类药物与单纯铂类药物治疗相比,联合贝伐珠单抗治疗组提高了总体缓解率(p = 0.003),降低了胸痛的发生率(p < 0.001),并缓解了 MPE 患者的呼吸困难(p = 0.002),治疗后胸腔积液中 VEGF 水平明显降低(p < 0.001)。

图:769 例伴有 MPE 的 NSCLC 患者 meta 分析结果,参考文献 3
重组人血管内皮抑制素与恶性胸腔积液
重组人血管内皮抑制素的作用机制:
近年的研究表明,肿瘤浸润或转移至胸、腹膜后,VEGF 水平升高、肿瘤新生血管生成以及血管通透性增加等是浆膜腔内积液形成新的重要机制。
重组人血管内皮抑制素注射液成分为内皮细胞抑制素(Endostatin),其本身就是血管生成抑制因子。血管内皮抑素能够特异性抑制血管内皮细胞迁移,诱导细胞凋亡,并可调节肿瘤细胞表面的 VEGF 表达及其活性,发挥多靶点抗血管生成的作用。
重组人血管内皮抑制素注射液(恩度)是我国学者自主创新和研发的新型重组人血管内皮抑制素,已获批一线治疗晚期非小细胞肺癌。
重组人血管内皮抑制素用于恶性胸腔积液的疗效:
为观察和确证腔内应用重组人血管内皮抑制素注射液(恩度)和 / 或顺铂治疗恶性胸腹腔积液的有效性和安全性,2011 年~2014 年在秦叔逵教授牵头下,在全国 14 家大型医院肿瘤中心开展了一项前瞻性、随机、平行对照、多中心的 III 期临床研究。
研究1
其中共有 317 例伴有中等量以上恶性胸腹腔积液的患者参与。
入选中等量以上恶性胸腹腔积液患者,随机分为 A 组(重组人血管内皮抑制素单药组)、B 组(顺铂单药组)和 C 组(重组人血管内皮抑制素联合顺铂组)。3 组均在充分穿刺抽液或引流后给药。
A 组腔内注射重组人血管内皮抑制素,45mg/次(胸腔)或 60 mg/次(腹腔);
B 组腔内注射顺铂,40m/次;
C 组为上述两种药物联合应用,剂量相同。
3 组给药时间均为用药第 1、4、7 天(d1、d4、d7),连用 3 次为 1 个疗程。最多可接受 2 个疗程的治疗。
结果显示,重组人血管内皮抑制素单药组(A 组)、顺铂单药组(B 组)和联合用药组(C 组)的 ORR 分别为 48.51%、46.39% 和 63.00%(P = 0.037),两两比较,C 组较 A 组、B 组高(P < 0.05);对于血性胸腔积液,A 组、C 组 ORR 分别为 71.42% 和 88.88%,均显著优于 B 组的 40.00%(P < 0.05)。
A、B、C 组的中位 TTP 分别为 68.869、44.951 和 69.030d(P = 0.012),两两比较,A 组、C 组的中位 TTP 均长于 B 组(P 值分别为 0.024、0.005)。
安全性方面,A 组不良事件发生率显著低于 B 组(P < 0.001),B 组、C 组之间差异无统计学意义(P = 0.287)。
推荐意见与讨论
由中国临床肿瘤学会血管靶向治疗专家委员会、中国临床肿瘤学会非小细胞肺癌专家委员会、中国临床肿瘤学会非小细胞肺癌抗血管生成药物治疗专家组共同编纂的 《晚期非小细胞肺癌抗血管生成药物治疗中国专家共识 (2020 版) 》 对于抗血管生成药物用于 MPE 的推荐意见为:
推荐意见 13:
伴有恶性胸腔积液的晚期非鳞 NSCLC 患者,可在全身治疗的基础上联合或局部使用贝伐珠单抗或重组人血管内皮抑制素 ( II 级推荐,1B 类证据)。
笔者认为, 从现实的临床实践和循证医学证据上看胸腔内注射抗血管生成药物疗效和安全性可。
但笔者认为该方案依然是颇具争议 ,一方面是该治疗方法强循证医学证据缺乏,导致该治疗方法尚未通过国内外药监部门的药品说明书核准,这也导致该治疗方法也未被国内外相关的临床诊疗指南所推荐,另一方面,在治疗过程中其不确定因素(给药剂量、间隔时间、给药次数)较多。
对于贝伐珠单抗胸腔灌注的剂量,山东省肿瘤医院一项 71 名患者的回顾性研究分析结果发现,低剂量(不高于 100 mg/次)的贝伐珠单抗和高剂量(高于 100 mg/次)的贝伐珠单抗相比,患者 PFS 和 OS 差异没有统计学意义,低剂量贝伐珠单抗组的不良事件发生率和程度明显低于高剂量组。
多数研究中,胸腔内给药的间隔时间为每 1~3 周给药 1 次,总共给药次数为 2~4 次。因而对于贝伐珠单抗胸腔灌注剂量和频次, 笔者推荐给药方法:100 mg/1~3 周,2~4 cycle。
另有一项比较贝伐珠单抗 vs. 重组人血管内皮抑制素联合顺铂胸腔灌注治疗肺腺癌恶性胸腔积液患者的临床疗效及安全性研究发现,贝伐珠单抗客观缓解率高于重组人血管内皮抑制素组(90.48% vs. 76.67%,P < 0.05),与治疗前相比,治疗后 2 组患者血清及胸腔积液中 CEA、CA125 均明显降低,贝伐珠单抗组血清及胸腔积液中降低更为明显 (P < 0.05)。
因而相比重组人血管内皮抑制素,笔者也更加倾向于使用贝伐珠单抗。
本文仅供医疗卫生等专业人士参考
策划:GoEun,梅浙
投稿及合作:yinqihang@dxy.cn
题图来源:站酷海洛PLUS
参考文献
1.Du N, Li X, Li F, Zhao H, Fan Z, Ma J, Fu Y, Kang H. Intrapleural combination therapy with bevacizumab and cisplatin for non-small cell lung cancer‑mediated malignant pleural effusion. Oncol Rep. 2013 Jun;29(6):2332-40.
2.Chen D, Song X, Shi F, Zhu H, Wang H, Zhang N, Zhang Y, Kong L, Yu J. Greater efficacy of intracavitary infusion of bevacizumab compared to traditional local treatments for patients with malignant cavity serous effusion. Oncotarget. 2017 May 23;8(21):35262-35271.
3.Zongwen S, Song K, Cong Z, Tian F, Yan Z. Evaluation of efficacy and safety for bevacizumab in treating malignant pleural effusions caused by lung cancer through intrapleural injection. Oncotarget. 2017 Dec 6;8(69):113318-113330
4. 中国临床肿瘤学会血管靶向治疗专家委员会, 中国临床肿瘤学会非小细胞肺癌专家委员会, 中国临床肿瘤学会非小细胞肺癌抗血管生成药物治疗专家组. 晚期非小细胞肺癌抗血管生成药物治疗中国专家共识(2020 版)[J]. 中华医学杂志,2020,100(46):3659-3673
5. 郑静娴, 王晓杰, 余家密, 余炜, 詹周伟, 周偲婧, 郭增清, 黄静. 贝伐珠单抗或重组人血管内皮抑制素联合顺铂胸腔灌注治疗肺腺癌恶性胸腔积液患者的临床研究 [J]. 中国临床药理学杂志,2021,37(24):3311-3314.
6. 刘玉杰, 田攀文. 贝伐珠单抗治疗非小细胞肺癌所致恶性胸腔积液的研究进展 [J]. 中国肺癌杂志,2019,22(2):118-124
7.Chen D, Song X, Zhang Y, Kong L, Wang H, Yu J. Optimizing intrapleural bevacizumab dosing in non-small-cell lung cancer-mediated malignant pleural effusion: less is more. Future Oncol. 2018 Sep;14(21):2131-2138.



